Metabolismo com nitrogênio alterado pode enfeitiçar o câncer
O Nitrogênio é um bloco de construção básico de todas as proteínas no corpo humano, no RNA e no DNA, de forma que os tumores cancerígenos são ávidos pelo elemento. Pesquisadores do Instituto Weizmann de Ciências, em colaboração com colegas do Instituto Nacional do Câncer (NCI) e de outras instituições, conseguiram demonstrar que em diversos tipos de câncer, o metabolismo do nitrogênio dos pacientes é alterado, produzindo alterações detectáveis nos fluidos corporais e contribuindo para o surgimento de novas mutações nos tecidos cancerosos. As constatações do estudo, publicadas recentemente na revista Cell, poderão facilitar a detecção precoce do câncer e a previsão dos resultados da imunoterapia no futuro.
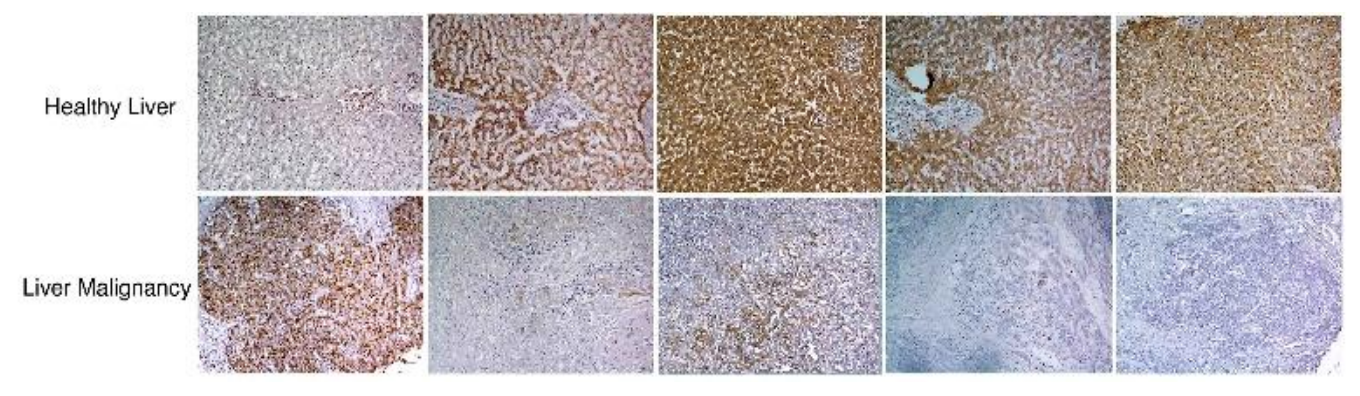
Coloração no tecido de um fígado normal (linha superior, quatro imagens a partir da direita) revelam altos níveis de quatro enzimas do ciclo ureico diferentes (marrons ou marrons avermelhadas), enquanto as amostras de câncer hepático (linha inferior, quatro imagens a partir da direita) contém níveis baixos dessas enzimas. Em contraste, os marcadores do crescimento das células são baixos no tecido normal (linha superior, à esquerda) e extremamente altos no câncer hepático (linha inferior, à esquerda). Imagem gerada com o auxílio da Dra. Raya Eilam
Quando o corpo utiliza o nitrogênio, gera uma substância derivada dos seus resíduos chamada ureia, em uma cadeia de reações bioquímicas que ocorrem no fígado, conhecidas como ciclo ureico. Em decorrência desse ciclo, a ureia é expelida na corrente sanguínea e posteriormente transformada em excreção do organismo na urina. Em uma pesquisa anterior, a Dra. Ayelet Erez do Departamento de Regulação Biológica do Instituto Weizmann demonstrou que uma das enzimas do ciclo ureico foi desativada em diversos tumores cancerígenos, aumentando a disponibilidade de nitrogênio para a síntese de uma substância orgânica conhecida como pirimidina, que por sua vez, serve de apoio à síntese de RNA e DNA e ao desenvolvimento do câncer.
No novo estudo, conduzido com o auxílio do Prof. Eytan Ruppin do Instituto Nacional do Câncer e outros pesquisadores, a equipe de Erez identificou uma série de alterações definidas com precisão em enzimas adicionais do ciclo ureico, que atuam em conjunto aumentando a disponibilidade de compostos de nitrogênio para a síntese de pirimidina. Essas alterações causaram um aumento no nível de pirimidina no tumor e uma pré-disposição para mutações do câncer.
Quando os pesquisadores modificaram a expressão das enzimas do ciclo ureico em tumores de câncer no cólon em camundongos, verificaram que esses camundongos – ao contrário do que ocorreu no grupo de controle – apresentaram níveis mais baixos de ureia no sangue, além de níveis detectáveis de pirimidina na urina. Em seguida, os pesquisadores verificaram os prontuários médicos de 100 pacientes de câncer pediátrico em tratamento no Centro Médico Sourasky em Tel Aviv, para conferir seus níveis de ureia. “Descobrimos que, no dia da internação no hospital, as crianças com câncer tinham níveis significativamente reduzidos de ureia no sangue, em comparação aos níveis registrados de ureia em crianças saudáveis da mesma idade” – disse Erez.
Essas constatações sugerem que as disfunções no ciclo ureico no fígado e em tumores podem causar a geração de marcadores relativos ao nitrogênio que podem facilitar a detecção precoce do câncer. Futuros ensaios poderão se basear em uma pontuação que combina medições dos níveis de ureia no sangue e de pirimidina na urina, para gerar um alerta de que o câncer pode estar se desenvolvendo no organismo.
“Ensaios padrão de laboratório verificam níveis altos de ureia no sangue, mas agora estamos comprovando que níveis baixos também são sinal de problemas” – afirmou Erez. “As células cancerígenas não desperdiçam nada, e utilizam o nitrogênio ao máximo em vez de descartá-lo na forma de ureia como as células normais fazem”.
Além disto, depois de examinar dados genômicos de câncer, os pesquisadores descobriram que as disfunções no ciclo ureico predominam em diversos tipos de câncer, e que vem acompanhadas de mutações específicas que resultam do aumento na síntese de pirimidina.
Essas mutações associadas à pirimidina são uma faca de dois gumes. Por um lado, tornam o câncer mais agressivo, reduzindo o tempo de sobrevivência do paciente, e por outro, geram fragmentos de proteína que tornam o tumor mais ‘sensível” que o de costume, afetando seu impacto no sistema imunológico. Portanto, tumores com disfunções no ciclo ureico têm maior probabilidade de serem suscetíveis à imunoterapia, pois o sistema imunológico do próprio paciente se mobiliza para combater o tumor. Um análise de pacientes com melanoma de fato revelou que os que tinham tumores caracterizados por disfunções no ciclo ureico eram mais propensos a reagirem à imunoterapia do que os que não apresentavam essas características. Quando os pesquisadores induziram as referidas disfunções no ciclo ureico em camundongos com tumores cancerosos, eles descobriram que os camundongos reagiam com muito mais eficiência à imunoterapia do que os portadores de tumores com atividade intacta das mesmas enzimas.
Se essas descobertas forem confirmadas em estudos mais abrangentes em animais e seres humanos, poderão dar ensejo a testes que possam ajudar a avaliar as chances de sucesso da imunoterapia com base nas colorações detectadas nas biópsias, em vez de uma análise genômica, muito mais difícil de se realizar. As disfunções nos níveis de expressão das enzimas da ureia no tecido afetado pelos tumores sugerem que o paciente tem maior probabilidade de reagir à imunoterapia.
“Outra possibilidade que vale a pena ser explorada é se a manipulação genética do tumor para induzir esse tipo de disfunção antes da imunoterapia poderia aumentar a eficácia do tratamento” – disse Erez. Essa manipulação envolveria o rompimento deliberado do ciclo ureico do tumor, na esperança de que as disfunções causadas gerem mutações relacionadas à pirimidina nas proteínas, o que ajudaria o sistema imunológico a identificar e destruir o tumor.
Participantes do estudo: Dra. Lital Adler, Dra. Narin Carmel, Shiran Rabinovich, Dr. Rom Keshet, Dra. Noa Stettner, Dr. Alon Silberman, Hila Weiss e Sivan Pinto do Departamento de Regulação Biológica, Dra. Lilach Agemy e Prof. Avigdor Scherz do Departamento de Ciências Ambientais e Botânicas, Dra. Raya Eilam do Departamento de Recursos Veterinários, Drs. Alexander Brandis, Sergey Malitsky e Maxim Itkin do Departamento de Ciências da Vida, Shelly Kalaora, Dr. Ronen Levy e Profa. Yardena Samuels do Departamento de Biologia Celular e Molecular, e Dra. Noam Stern Ginossar do Departamento de Genética Molecular – todos do Instituto Weizmann de Ciências; Dra. Joo Sang Lee, Hiren Karathia, Noam Auslander e Prof. Sridhar Hannenhalli da Universidade de Maryland; Daniel Helbling e Dr. David Dimmock da Faculdade de Medicina de Wisconsin; Dr. Qin Sol e Dr. Sandesh CS Nagamani da Faculdade Baylor de Medicina; Eilon Barnea e Prof. Arie Admon da Technion – Faculdade Israelense de Tecnologia; Miguel Unda e Prof. Arkaitz Carracedo do Hospital Universitário de Basurto em Bilbao, Espanha; Dr. David M Wilson III do Instituto Nacional do Envelhecimento; e Dr. Ronit Elhasid do Centro Médico de Sourasky, em Tel Aviv.
A pesquisa da Dra. Ayelet Erez tem o apoio da Fundação Adelis; da Fundação Rising Tide; do Consórcio da Família Comisaroff; do Fundo Irving B. Harris para Novos Direcionamentos em Pesquisas do Cérebro; e do Conselho Europeu de Pesquisa. A Dra. Erez é a encarregada da Cadeira de Desenvolvimento profissional Leah Omenn.